Proprieta termodinamiche
- Pubblicato: Domenica, 27 Giugno 2010 05:03
- Scritto da Super User
- Visite: 14320
Proprietà termodinamiche dell’aria secca a pressione atmosferica ( 101.325 kPa ).
|
Temperatura
|
Massa volumica
|
Viscosità dinamica
|
Viscosità cinematica
|
Capacità termica massica
|
Conduttività termica
|
Numero di Prandtl
|
Diffusività termica
|
Coefficiente di dilatazione
|
|
ρ
|
µ·106
|
ν·106
|
Cp
|
k
|
Pr
|
α·106
|
ß·10³
|
|
|
°C
|
kg/m³
|
N·s/m²
|
m²/s
|
J/(kg·k)
|
W/(m·K)
|
m²/s
|
1/K
|
|
|
-20
|
1.3958
|
16.222
|
11.622
|
1005.4
|
0.0225
|
0.72
|
16.038
|
3.95
|
|
-10
|
1.3426
|
16.731
|
12.462
|
1005.5
|
0.0232
|
0.72
|
17.257
|
3.800
|
|
0
|
1.2933
|
17.231
|
13.324
|
1005.6
|
0.0240
|
0.71
|
18.511
|
3.661
|
|
10
|
1.2474
|
17.722
|
14.207
|
1005.8
|
0.0248
|
0.71
|
19.798
|
3.531
|
|
20
|
1.2047
|
18.205
|
15.111
|
1006.1
|
0.0255
|
0.71
|
21.111
|
3.411
|
|
30
|
1.1649
|
18.680
|
16.036
|
1006.5
|
0.0263
|
0.71
|
22.468
|
3.298
|
|
40
|
1.1275
|
19.148
|
16.982
|
1006.9
|
0.0270
|
0.71
|
23.848
|
3.193
|
|
50
|
1.0925
|
19.608
|
17.947
|
1007.4
|
0.0278
|
0.71
|
25.258
|
3.094
|
|
60
|
1.0597
|
20.061
|
18.931
|
1008.1
|
0.0285
|
0.71
|
26.696
|
3.001
|
|
70
|
1.0287
|
20.507
|
19.935
|
1008.7
|
0.0292
|
0.70
|
28.162
|
2.914
|
|
80
|
0.9994
|
20.947
|
20.958
|
1009.5
|
0.0299
|
0.70
|
29.654
|
2.831
|
|
90
|
0.9994
|
20.947
|
20.958
|
1010.4
|
0.0299
|
0.70
|
29.654
|
2.831
|
|
100
|
0.9457
|
21.808
|
23.058
|
1011.3
|
0.0312
|
0.70
|
32.714
|
2.679
|
|
110
|
0.9210
|
22.229
|
24.135
|
1012.3
|
0.0319
|
0.70
|
34.280
|
2.609
|
|
120
|
0.8975
|
22.645
|
25.230
|
1013.4
|
0.0326
|
0.70
|
35.869
|
2.543
|
- Categoria: Aria secca
Equazioni termodinamiche
- Pubblicato: Domenica, 27 Giugno 2010 05:02
- Scritto da Super User
- Visite: 14220
L’aria secca, per gli usi tecnologici, viene paragonata con le dovute approssimazioni ad un gas perfetto e quindi è soggetta ad una serie di equazioni e di considerazioni tipiche di un gas perfetto.
In un gas perfetto si considera che la capacità termica massica sia costante durante le varie trasformazioni termodinamiche e l’equazione che lega il volume occupato, la temperatura e la pressione è detta equazione di stato di un gas perfetto definita nei seguenti termini:
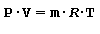
in cui:
P pressione [ bar ]
V volume occupato [ m3 ] m massa [kg]
R costante del gas che per l’aria è pari a 287.05 [ KJ/kg⋅K ]
T temperatura termodinamica in gradi Kelvin [ K ] ove ( 0 ºC corrisponde a 273,15 K )
Prima di valutare le varie trasformazioni che avvengono nei normali processi tecnologici si devono definire alcune terminologie:
Calore Si definisce Calore Q l’energia scambiata tra il sistema ed il suo contorno e solo nel momento in cui attraversa il sistema. Il calore non può essere immagazzinato e può essere solo convertito in qualche altra forma di energia solo dopo aver attraversato il contorno del sistema. La differenza di temperatura che è l’elemento essenziale che determina il trasferimento di calore è come stabilito dal II° principio della termodinamica il calore scambiato dai corpi o sistemi a temperatura più alta verso quelli a temperatura più bassa. Per convezione si assume che il trasferimento di calore sia positivo quando il calore viene aggiunto (entra) al sistema, mentre è negativo quando il calore viene rimosso (esce) dal sistema termodinamico.
Lavoro Si definisce Lavoro L l’energia scambiata tra il sistema e l’esterno ove la variabile che pilota lo scambio di energia non è la temperatura, come nel calore, ma una qualsiasi altra cosa diversa dalla temperatura. Per convenzione il lavoro è positivo quando è prodotto dal sistema (energia che esce dal sistema), mentre è negativo quando viene fatto sul sistema (energia che entra).
Entalpia Si definisce entalpia H oppure entalpia massica h la somma dell’energia interna del sistema u e del prodotto della pressione P per il volume massico V ed è quindi data da:
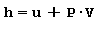
Entropia Si definisce entropia s una funzione di stato che misura la preferenza in natura per alcune trasformazioni ove la quantità di calore viene assorbita o ceduta in maniera reversibile ad una certa temperatura assoluta rispetto ad un determinato sistema di riferimento. Pertanto la variazione ideale di entropia riferita alla massa è data da:
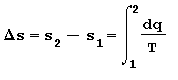
in cui:
dq è l’incremento infinitesimo del calore entrante (+) o uscente (-)
T è la temperatura assoluta del sistema. [ K ]
Capacita termica massica:
- Capacita termica massica a pressione costante Cp è la variazione di entalpia Δh per una variazione di temperatura ΔT in una trasformazione a pressione costante:
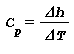
- Capacita termica massica a volume costante Cv è la variazione di energia interna Δu per una variazione di temperatura ΔT in una trasformazione a volume costante:
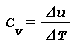
Per il I° principio della termodinamica le capacità termiche Cp e Cv sono legate alla costante del gas dalla relazione:
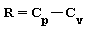
Trasformazione ISOCORA ossia a volume costante Somministrando del calore all’aria contenuta in un recipiente a pareti rigide la temperatura e la pressione aumentano. Il lavoro scambiato è nullo in quanto non c’è variazione di volume mentre la quantità di calore necessaria per passare dalla temperatura iniziale T1 alla temperatura finale T2 risulta:
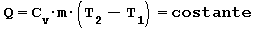
in cui:
Cv capacità termica massica a volume costante
m massa [ kg ]
L’aumento di pressione è legato all’aumento di temperatura dalla relazione seguente ricavabile dall’equazione di stato:
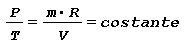
Tale relazione applicata alla variazione di temperatura tra T1 e T2 conduce a:
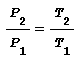
nota anche come legge di Amonton dalla quale si deduce che in una trasformazione a volume costante il rapporto tra le pressioni è uguale al rapporto tra le temperature.
Trasformazione ISOBARA ossia a pressione costante Se somministriamo del calore all’aria contenuta in un recipiente capace di mantenere la pressione costante la temperatura e il volume aumentano. La quantità di calore necessaria per passare dalla temperatura iniziale T1 alla temperatura finale T2 è uguale all’entalpia e risulta:
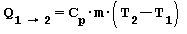
in cui:
Cp capacita termica massica a pressione costante
m massa [ kg ]
L’aumento di volume è legato all’aumento di temperatura dalla relazione seguente ricavabile dall’equazione di stato:
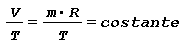
Tale relazione applicata alla variazione di temperatura tra T1 e T2 conduce a:
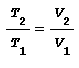
nota anche come legge di Charles dalla quale si deduce che in una trasformazione a pressione costante il rapporto tra i volumi e uguale al rapporto tra le temperature.
Trasformazione ISOTERMA ossia a temperatura costante Comprimendo dell’aria all’interno di un recipiente e sottraendo il calore generato in modo da mantenere la temperatura costante l’equazione di stato diventa:
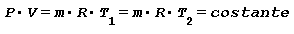
Tale relazione applicata alla variazione di volume diventa:
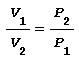
nota anche come legge di Boyle si deduce che il rapporto tra la variazione di pressione è inversamente proporzionale al rapporto tra la variazione di volume tramite un’equazione iperbolica equilatera. Il lavoro scambiato L1-2 durante questa trasformazione coincide con il calore Q1-2 e quindi risulta:
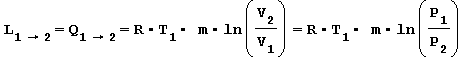
Trasformazione ADIABATICA ossia senza scambio di calore con l’esterno Trasformazione reversibile che avviene senza lo scambio termico con l’ambiente esterno ma solo con la variazione di lavoro e in base alla legge di Poisson risulta cosi espressa:
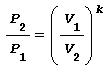
in cui:
k , che per l’aria risulta k=1,4, è il rapporto tra la capacità termica massica a pressione costante e la capacità termica massica a volume costante ovvero:
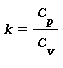
Altre equazioni utili equivalenti alla legge di Poisson sono:
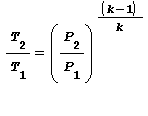
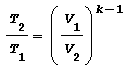
Trasformazione POLITROPICA ossia con scambio di calore con l’esterno Trasformazione reversibile ove si hanno variazione di temperatura, volume, pressione e scambio termico legati dalla seguente relazione:
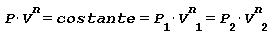
in cui:
n viene definito come esponente della politropica e assegnandoli un determinato valore si possono comprendere all’interno di questa equazione tutte le trasformazioni fino ad ora esaminate:
- n = 0 Trasformazione isobara
- n = 1 Trasformazione isoterma
- n = k Trasformazione adiabatica
- n = ∞ Trasformazione isocora
- Categoria: Aria secca
Introduzione
- Pubblicato: Domenica, 27 Giugno 2010 05:01
- Scritto da Super User
- Visite: 9143
L’aria atmosferica è una miscela di diversi gas e la sua composizione, che varia in modo trascurabile in base alla località, senza la presenza di elementi esterni come polveri, sabbia, pollini e anche senza vapor d’acqua ossia a secco è la seguente:
Composizione dell’aria secca (senza vapor d’acqua)
|
Componente
|
Formula
|
Percentuale in volume
|
Percentuale in massa
|
|
% |
% |
||
|
Azoto
|
N2
|
78.090
|
75.51
|
|
Ossigeno
|
O2
|
20.950
|
23.15
|
|
Argon
|
Ar
|
0.930
|
1.28
|
|
Anidride carbonica
|
CO2
|
0.030
|
0.046
|
|
Neon
|
Ne
|
0.00181
|
0.00125
|
|
Elio
|
He
|
0.00052
|
0.000072
|
|
Metano
|
CH4
|
0.00015
|
0.000094
|
|
Kripto
|
Kr
|
0.00011
|
0.00029
|
|
Idrogeno
|
H2
|
0.00005
|
0.0000035
|
|
Ozono
|
O3
|
0.00004
|
0.000007
|
|
Xenon
|
Xe
|
0.000008
|
0.0000035
|
Per convenzione si considera l’aria atmosferica "tipo" quella rilevata al livello del mare (accelerazione di gravitag= 9,807 m/s2) ed alla temperatura di 15°C. La sua pressione assoluta (pressione atmosferica di riferimento) è di 101,325 kPa ovvero 1,01325 bar (760 mm di Hg). Supponendo che l’aria atmosferica si comporti come un gas perfetto e che la sua temperatura sia in funzione lineare della sua quota rispetto al lvello del mare la pressione atmosferica e la densità variano come dalla seguente tabella:
Variazione di pressione assoluta, temperatura e densità in funzione della quota dell’aria secca standard.
|
Altezza sul livello del mare
|
Pressione
|
Temperatura
|
Densità
|
Velocità del suono
|
|
m
|
Pa
|
°C
|
Kg/m³
|
m/s
|
|
0
|
101325
|
15.00
|
1.225
|
340.2941
|
|
50
|
100725
|
14.67
|
1.219
|
340.1021
|
|
100
|
100129
|
14.35
|
1.213
|
339.9103
|
|
150
|
99535
|
14.02
|
1.207
|
339.7179
|
|
200
|
98945
|
13.70
|
1.202
|
339.5256
|
|
250
|
98357
|
13.37
|
1.195
|
339.3332
|
|
300
|
97772
|
13.05
|
1.190
|
339.1407
|
|
350
|
97190
|
12.72
|
1.184
|
338.9481
|
|
400
|
96610
|
12.40
|
1.179
|
338.7553
|
|
450
|
96034
|
12.07
|
1.172
|
338.5625
|
|
500
|
95460
|
11.75
|
1.167
|
338.3696
|
|
550
|
94889
|
11.42
|
1.161
|
338.1765
|
|
600
|
94321
|
11.10
|
1.156
|
337.9833
|
|
650
|
93756
|
10.77
|
1.150
|
337.7901
|
|
700
|
93193
|
10.45
|
1.145
|
337.5967
|
|
750
|
92633
|
10.12
|
1.139
|
337.4032
|
|
800
|
92076
|
9.80
|
1.134
|
337.2096
|
|
850
|
91521
|
9.47
|
1.128
|
337.0159
|
|
900
|
90970
|
9.15
|
1.223
|
336.8220
|
|
950
|
90420
|
8.82
|
1.117
|
336.6281
|
|
1000
|
89874
|
8.50
|
1.112
|
336.4340
|
- Categoria: Aria secca

 Italian (IT)
Italian (IT)  English (UK)
English (UK)