Introduzione
- Category: Info
- Published: Sunday, 27 June 2010 06:22
- Written by Super User
- Hits: 11672
- Fusione Si definisce con questo termine il passaggio dalla fase solida alla fase liquida. Durante questa fase il calore che viene somministrato alla sostanza non va ad aumentare la temperatura finchè non sia avvenuta la fusione completa ovvero la trasformazione di tutto il ghiaccio in liquido. Tale calore, detto calore di fusione, si definisce come la quantità di calore necessaria per fondere una massa unitaria alla sua temperatura di fusione che per l’acqua risulta di 333.6 kJ/kg alla pressione di 101.325 kPa.
- Vaporizzazione Si definisce con questo termine generico il passaggio di un liquido allo stato di vapore. Se tale passaggio di stato avviene solo superficialmente al liquido si chiama evaporazione mentre se avviene anche internamente al liquido dove si sprigionano numerose bolle che salgono in superficie si chiama ebollizione. Durante questa fase il calore che viene somministrato serve solamente per trasformare il liquido in vapore e quindi la temperatura rimane costante fin tanto che il liquido non si sia trasformato completamente in vapore. Se durante questa trasformazione si ha presenza del liquido che lo ha generato il vapore si chiama vapore saturo mentre se tutto il liquido si e trasformato in vapore si chiama vapore secco. Tale calore detto calore latente di vaporizzazione è la quantità di calore necessaria per trasformare completamente in vapore una massa unitaria di liquido quando questo si trova alla temperatura di ebollizione. Per l’acqua alla pressione di 101.325 kPa il calore latente di vaporizzazione è pari a 2256 kJ/kg. Se somministriamo ulteriore calore dopo che tutto il liquido si è trasformato in vapore la temperatura inizia a salire e in queste condizioni il vapore si chiama vapore surriscaldato in quanto si trova ad una temperatura superiore alla temperatura di ebollizione corrispondente alla pressione cui è sottoposto.
Lo stato di equilibrio o il cambiamento di fase dipendono dalla temperatura e dalla pressione e pertanto la pressione che un vapore saturo, secco o surriscaldato che esercita sulle pareti del recipiente che lo contiene, denominata tensione di vapore, dipende esclusivamente dalla temperatura a cui esso si trova e quindi è indipendente, a differenza di un gas, dal volume occupato. Quindi il passaggio da liquido a vapore ad una data temperatura, chiamata temperatura di vaporizzazione o di ebollizione, è più alta se la pressione sovrastante il liquido è maggiore.
Temperatura di vaporizzazione dell’acqua in funzione della pressione
|
Pressione
|
Temperatura di vaporizzazione
|
Pressione
|
Temperatura di vaporizzazione
|
|
KPa
|
°C
|
KPa
|
°C
|
|
1
|
6.9696
|
800
|
170.406
|
|
5
|
32.8743
|
850
|
172.936
|
|
7.5
|
40.2903
|
900
|
175.35
|
|
10
|
45.8063
|
950
|
177.661
|
|
20
|
60.058
|
1000
|
179.878
|
|
30
|
69.0952
|
2000
|
212.377
|
|
40
|
75.8568
|
3000
|
233.853
|
|
50
|
81.3169
|
4000
|
250.354
|
|
60
|
85.926
|
5000
|
263.941
|
|
70
|
89.9317
|
6000
|
275.585
|
|
80
|
93.4855
|
7000
|
285.829
|
|
90
|
96.6871
|
8000
|
295.008
|
|
100
|
99.6059
|
9000
|
303.345
|
|
101.5
|
100.000
|
10000
|
310.997
|
|
150
|
111.349
|
11000
|
318.079
|
|
200
|
120.21
|
12000
|
324.675
|
|
250
|
127.411
|
13000
|
330.854
|
|
300
|
133.522
|
14000
|
336.666
|
|
350
|
138.857
|
15000
|
342.155
|
|
400
|
143.608
|
16000
|
347.355
|
|
450
|
147.903
|
17000
|
352.293
|
|
500
|
151.831
|
18000
|
356.992
|
|
550
|
155.456
|
19000
|
361.473
|
|
600
|
158.826
|
20000
|
365.749
|
|
650
|
161.980
|
21000
|
369.827
|
|
700
|
164.946
|
22000
|
373.705
|
|
750
|
167.749
|
22064
|
373.946
|
Esaminiamo in dettaglio il cambiamento di fase di 1 Kg di acqua contenuta in un recipiente posto alla temperatura iniziale di 20°C e capace di mantenere la pressione costante di 0.1 MPa. Ora iniziamo a fornire calore all’acqua: la temperatura inizia a salire, il volume occupato aumenta di poco mentre la pressione rimane costante. Pochi istanti prima che inizi la trasformazione di parte del liquido a vapore, che nel nostro caso corrisponde a circa 99.65 °C il liquido viene denominato liquido saturo in quanto una minima aggiunta di calore determina l’inizio della trasformazione liquido-vapore. Il valore della temperatura e della pressione in corrispondenza del passaggio da liquido a vapore vengono chiamati rispettivamente temperatura di saturazione e pressione di saturazione. Durante la successiva trasformazione del liquido a vapore si ha un notevole aumento del volume massico mentre la temperatura rimane costante e durante questa fase il vapore viene definito vapore saturo in quanto si ha la presenza del liquido che lo ha generato. Pochi istanti dopo che tutto il liquido si è trasformato in vapore il vapore si dice vapore secco in quanto tutto il calore che gli è stato somministrato è servito per trasformare l’acqua in vapore senza aumentare la temperatura. Se si continua a somministrare del calore la temperatura inizia a salire e parallelamente inizia a salire anche il volume massico del vapore. In queste condizioni il vapore si dice vapore surriscaldato in quanto si trova ad una temperatura superiore alla temperatura di saturazione 99.63°C alla specifica pressione di 0.1 MPa.
Il calore fornito durante la trasformazione a pressione costante è uguale alla variazione di entalpia ne consegue che durante il cambiamento di fase il calore che deve essere somministrato viene chiamato entalpia di fusione o entalpia di vaporizzazione se avvengono rispettivamente durante i cambiamenti di fase di fusione o di vaporizzazione.
Il titolo del vapore x è una grandezza adimensionale, caratteristica del vapore saturo, che indica quanto vapore saturo secco è contenuto nella miscela stessa.
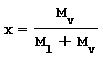
Dove:
Mv: Massa del vapore
Ml: Massa del liquido
Se si ha un titolo pari a 0.9 ossia al 90% significa che la miscela contiene il 10% di massa liquido e per il restante 90% di massa vapore. Inoltre nel caso sia tutto liquido x = 0 mentre se tutto vapore saturo secco x = 1.
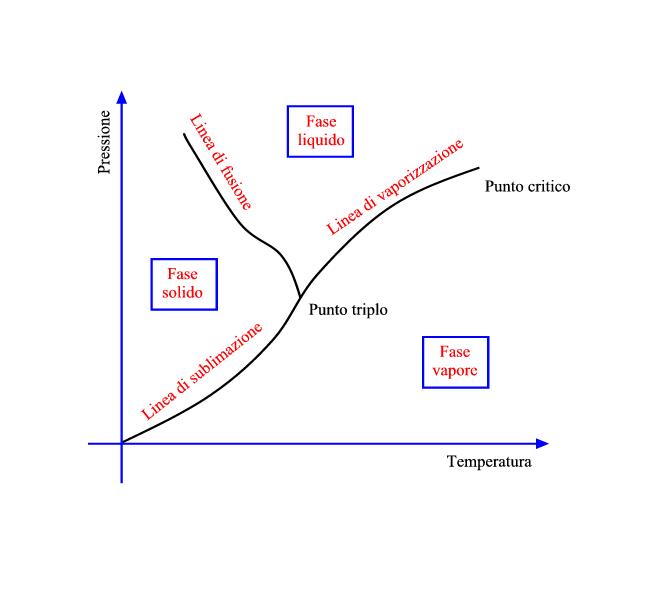
- Linea di sublimazione che indica la linea di equilibrio tra la fase solido e la fase vapore.
- Punto triplo ovvero il solo ed unico punto di equilibrio dove possono coesistere tutte e tre le fasi che per l’acqua pura viene definito dalla temperatura di 0.01°C alla pressione di 0.61173 kPa.
- Linea di vaporizzazione definisce la linea di equilibrio tra fase liquido e fase vapore fino al punto denominato punto critico, 220.64 kPa a 373.946°C, oltrepassato il quale non è piu possibile un cambiamento distinto di fase in quanto il vapore si comporta come un gas.

 Italian (IT)
Italian (IT)  English (UK)
English (UK)